-
jinnian金年会官网
- ACD/Labs
- Certara
- Labware / Sparta Systems
- Materials Design
- OmniComm System
- OPENTEXT
- QIAGEN
- UL
-
jinnianhui金年会官网
- 热线:021-32504385
- 微博:jinnian金年会官方网站入口
- 邮件:hzdongrun

2024-11-25 04:27:56来源:jinnianhui金年会官网 作者:jinnian金年会官网
危险信号分子(DAMPs)是细胞因损伤或应激产生的内源信号分子,在介导固有免疫和炎症反应中发挥重要作用。尽管这些内源性分子在稳态状态下不会诱导炎症反应,但是当机体遭受损伤、应激后,其分布、浓度或理化性质会发生改变,从而转变成DAMPs并被免疫系统感应并促进固有免疫应答和炎症发生。近年来的研究发现DAMPs及其介导的炎症反应在多种重大慢性疾病的发生发展中起关键作用。因此,对DAMPs及其诱导的炎症反应的深入理解不仅有助于揭示免疫应答的本质,也有助于发展新的免疫疗法。
4月10日,中国科学技术大学周荣斌教授团队受邀在Immunity创刊30周年特刊上发表题为“DAMPs and DAMP-sensing receptors in inflammation and diseases”的综述,系统总结了DAMP的形成途径、分子特征、调控及感应机制,并讨论了靶向危险感应受体的治疗策略,并对DAMP相关研究中的关键问题进行了梳理和展望。
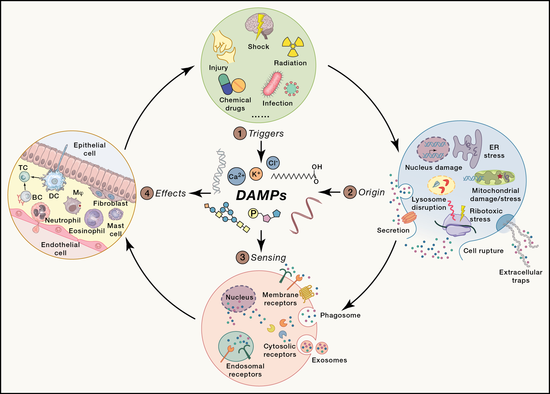
在静息状态下,内源分子作为机体的组成部分,处于免疫豁免状态,并不诱导炎症反应。但是,在细胞遭受损伤或应激时,一些内源分子发生位置、浓度或理化性质的改变,转变成可被免疫系统感应DAMPs。位置改变使得一些内源分子失去细胞/细胞器膜的保护或免疫耐受的环境,从而使其具有促炎作用。例如,ATP、内源性核酸等内源性分子从胞内转移至胞外,可被一些免疫受体识别并促进炎症反应。细胞器内的一些内源性分子在遭受应激时会被释放到细胞质,从而激活胞内的免疫受体。此外,一些内源分子的跨器官运输可以使其从耐受组织或器官进入不耐受的组织或器官,进而诱导炎症反应。内源分子的性质改变包括物理性质和化学性质的改变。在高浓度、低流速的情况下,体液中的某些分子,比如尿酸、胆固醇等,易析出结晶并通过激活NLRP3炎症小体促进炎症反应。另外,内源分子的降解、错误折叠、修饰可导致其化学性质的变化从而获得促进固有免疫应答和炎症反应的能力。有些内源分子的促炎活性与其浓度相关,例如蛋白聚糖、脂肪酸等,在低浓度下不会诱导炎症反应,而高浓度时则被机体视为危险信号。
按照分子特征,可将DAMP分为五类:核酸、蛋白质、离子、聚糖、代谢产物。核酸类DAMP主要包括细胞核或线粒体释放的DNA以及丢失保护性结构的RNA,他们可被胞浆中的DNA感受器cGAS、AIM2、RIG-I等受体识别。蛋白质和多肽类DAMP主要包括细胞死亡或者应激后释放的HMGB1、组蛋白、糖蛋白、α-MSH多肽等。细胞内钾离子、氯离子和钙离子等离子的变化也可作为一种危险信号,被NLRP3等受体感应从而激活固有免疫和炎症反应。聚糖类DAMP多数分布于细胞外基质,可被TLR、CD44、RAGE等受体识别介导炎症反应。代谢类DAMP,包括脂类、糖、核酸的代谢产物,其积累可作为危险信号诱导炎症反应的发生。综上,DAMP分子特征的多样性一方面保障了DAMP作为警报信号的即时性,另一方面,也使得在炎症反应中的病理机制更加复杂多变。
DAMPs在炎症反应和组织修复中都发挥关键作用,因此其产生须受到严格调控,以应对损伤中的复杂情况。近年来,多项细胞进程被发现与DAMP的产生密切相关。细胞坏死、焦亡、铁死亡导致的胞内物质泄漏可将胞内物质暴露在环境中,从而可与受体作用,诱导炎症反应。内质网、核糖体、线粒体等细胞器遭受应激和损伤后也能产生一些DAMPs分子从而促进炎症反应。细胞内的代谢失调可导致胞内核酸、未折叠蛋白、糖代谢产物等DAMPs的堆积。综上,稳态失衡或死亡的细胞可产生并释放大量的内源分子,探明其中关键的DAMP分子及其影响炎症和疾病的机制具有重要的科学和临床意义。
DAMP通过作用于危险感应受体以活化炎症信号通,因此,在DAMP介导炎症反应的过程中,危险感应受体是非常关键的环节。起初,科学家发现负责识别病原相关分子模式(PAMP)的模式识别受体(PRR)也可以识别DAMP,例如:Toll样受体可以识别HMGB1,microRNA等;C型凝集素受体可识别聚糖、SAP130、F-actin;RIG-I样受体可识别内源的RNA;DNA感受器识别内源DNA。NLRP3是NOD样受体家族的成员,可以感应和识别多种DAMP分子,包括氧化的线粒体DNA、组蛋白、离子流动、脂代谢产物、结晶、蛋白斑块等,介导炎症小体活化。这些模式识别受体的活化将引发下游信号通路的活化,产生IL-6、IL-1β、I-IFN等细胞因子,促进神经退行性疾病、代谢性疾病、肿瘤等疾病的发生和发展。随着近年来学界对危险感应受体的深入研究,一些新的受体,例如GPCR、ZBP1等,也被发现可以作为危险感应受体识别DAMP并介导炎症反应,同样也在一系列重大疾病中扮演重要角色。
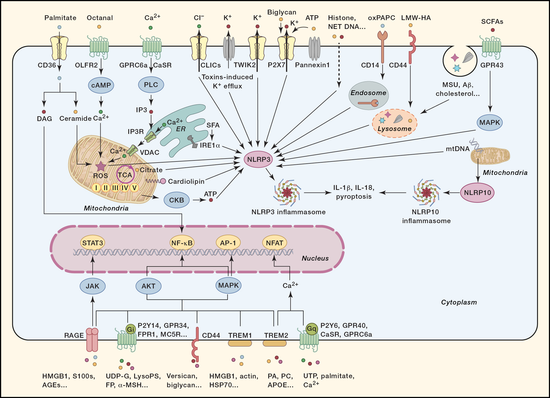
由于危险感应受体对多种重大疾病的发生发展具有促进作用,因此抑制危险感应受体有可能为这些重大疾病提供新的干预策略。临床前研究发现,多种NLRP3特异性对阿兹海默症、二型糖尿病、痛风等疾病都具有良好的治疗效果;靶向cGAS的拮抗剂在小鼠的AGS综合征疾病模型中具有显著的治疗效果;Toll样受体拮抗剂可缓解肝损伤、动脉粥样硬化等疾病的症状。尽管靶向危险感应受体的拮抗剂在动物实验中取得了许多可喜的结果,但进入临床研究的药物仍然非常缺乏。一些NLRP3的已经进入了临床研究阶段,比如colchicine、 ZY-IL1、OLT1177等。此外,靶向TLR4、TLR7等受体等的药物也在临床研究中显示了一定的疗效。尽管靶向危险感应受体的临床干预具有很大的发展潜力,但目前尚在起步阶段。
本综述提出了内源性分子转变成DAMP的三种途径,系统梳理了DAMPs的分类,来源及感应机制,并对该领域内亟需解决的问题和未来的重点研究方向进行了展望,有助于激发和推动该领域的基础和应用研究。
